معادله فیزیکی شرودینگر (Schrödinger equation) برای یک سامانه کوانتومی است. این معادله یک معادله جبری ساده نیست ولی (عموماً) یک معادله دیفرانسیل جزئی خطی است. در تفسیر استاندارد از فیزیک کوانتومی، تابع موج کاملترین توضیحی است که میتوان در مورد یک سامانه فیزیکی داد. راه حلهای معادله شرودینگر سامانههای مولکولی، اتمی و ریز اتمی را توصیف میکند. در واقع سیستمهای ماکروسکوپی، حتی کل جهان را نیز توصیف میکند.
مدل اوربیتالی اتم در معادله فیزیکی شرودینگر
شرودینگر با در نظر گرفتن خصلت موجی برای الكترون معادله ای برای توصیف رفتار الكترون ها در اتم پیشنهاد كرد. در واقع الکترونها در اتمها و مولکولها بصورت امواج ایستا هستند که ویژگی های آن از حل معادله شرودینگر بدست می آید. از حل معادله ی شرودینگر برای هر سیستم یا اتم دلخواه یك سری توابع موجی ( که آنها را با ![]() یا
یا ![]() ) بدست می آیند. توابع موجی با گرفتن موقعیت مکانی یک نقطه دلخواه در فضا و زمان بعنوان ورودی، دامنه موج نسبت داده شده به الکترون را در آن نقطه بعنوان خروجی نتیجه می دهند.
) بدست می آیند. توابع موجی با گرفتن موقعیت مکانی یک نقطه دلخواه در فضا و زمان بعنوان ورودی، دامنه موج نسبت داده شده به الکترون را در آن نقطه بعنوان خروجی نتیجه می دهند.
شاید مفهوم فیزیکی خود تابع موجی چندان ملموس نباشد. اما برای مجذور آن یعنی ![]() اینگونه نیست. مجذور تابع موجی یعنی
اینگونه نیست. مجذور تابع موجی یعنی ![]() بیانگر احتمال حضور الكترون است. به طوریکه با دادن فاصله و جهت آن نسبت به هسته به عنوان ورودی به تابع
بیانگر احتمال حضور الكترون است. به طوریکه با دادن فاصله و جهت آن نسبت به هسته به عنوان ورودی به تابع ![]() این تابع احتمال حضور الكترون در آن مختصات را به عنوان خروجی می دهد. بدین صورت در اینجا الکترون موج فرض می شود. مثل یک موج حالت پخش شدگی دارد. در ادامه با کاربرد فیزیکی معادله شرودینگر بیشتر آشنا خواهید شد.
این تابع احتمال حضور الكترون در آن مختصات را به عنوان خروجی می دهد. بدین صورت در اینجا الکترون موج فرض می شود. مثل یک موج حالت پخش شدگی دارد. در ادامه با کاربرد فیزیکی معادله شرودینگر بیشتر آشنا خواهید شد.
ساختار اوربیتال
معادله شرودینگر برای اتم هیدروژن یا بطور کلی تر سیستم های تک الکترونی حل شده است. توابع موجی مربوطه بطور دقیق بدست آمده اند. بنابراین اوربیتالهای سیستم های تک الکترونی و کلیه ویژگیهایشان کاملا بطور دقیق معلوم هستند. متاسفانه حل معادله شرودینگر برای سیستم های چند الکترونی بر خلاف سیستم های تک الکترونی براحتی مقدور نیست. برای اغلب سیستم های چند الکترونی حل دقیق معادله شرودینگر با توجه به روشهای ریاضی موجود است. قابل ذکر است از توان محاسباتی کامپیوترها مقدور نیست. از این رو تعیین دقیق اوربیتالهای سیستم های چند الکترونی و ویژگیهایشان بطور نظری امکان پذیر نیست.
خوشبختانه مشاهدات تجربی دال بر اینست که اوربیتالهای سیستم های چند الکترونی کمابیش مشابه اوربیتالهای بدست آمده برای سیستم های تک الکترونی هستند. از این رو اوربیتالهای سیستم های تک الکترونی مثل اتم هیدروژن برای مابقی اتمها نیز می توانند بکار گرفته شوند. بهر حال بایستی در نظر داشت که در سیستم های چند الکترونی، حضور الکترونهای دیگر تابع موجی بدست آمده برای هر الکترون یا همان ابر الکترونی هر الکترون را تحت تاثیر قرار می دهند. ممکن است در برخی موارد ( مثل اتمهای با عدد اتمی بالا) این تاثیرات بحدی زیاد باشند، که اوربیتالهای سیستم های چند الکترونی تفاوتهای قابل توجه و غیر قابل صرف نظر کردنی با اوربیتالهای سیستم های تک الکترونی داشته باشند.
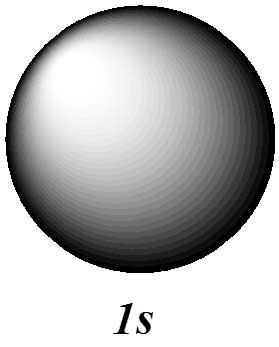
نمودار سطح مرزی اوربیتال 1s
امواج انرژی تابع در معادله ذره در جعبه
از آنجائیکه برای امواج انرژی موج متناسب با مجذور دامنه است، نقاطی از فضا که در آنها مجذور دامنه بزرگتر است. قسمت بیشتری از انرژی موج یا در واقع خود موج را شامل می شوند. بنابراین مجذور تابع موجی در یک نقطه معیاری از مقدار حضور الکترون در آن نقطه است. همچنین احتمال حضور الكترون در آن مختصات است. برای کمک به درک بهتر به تشابه در ادامه آمده توجه کنید. فرض کنید مقداری آب مایع درون یک لیوان داشته باشیم. با دادن انرژی آن را به صورت بخار یا یک ابر در آوریم. ابر حاصل شکل های متفاوتی می تواند داشته باشد. همچنین هر نقطه از ابر می تواند غلظت متفاوتی از بخار آب داشته باشد. در ابتدا (آب مایع درون لیوان) آب را به صورت متمرکز داریم. در حالی که بعد از تبخیر آن را به صورت پخش شده که پخش شدگی اش شکل های متفاوتی می تواند داشته باشد، داریم.
همچنین الکترون در اتم نیز می تواند بصورت یک ابر در نظر گرفته شود که آن ابر شکل های متفاوتی می تواند داشته باشد. هر نقطه از ابر می تواند غلظت متفاوتی داشته باشد. شکل این ابر الکترونی و غلظت الکترون در هر نقطه از آن از روی تابع موجی مربوطه که از حل معادله شرودینگر نتیجه می شود، بدست می آید. با ادامه موضوع کاربرد فیزیکی معادله شرودینگر با شماییم.
کاربرد تابع حضور در معادله شرودینگر
بطور کاربردی، هر تابع موجی معادل یك نحوه ی خاص اشغال اطراف هسته توسط الكترون است. به همین علت متناظر با یك سطح انرژی خاص و مشخص برای الكترونی ست كه ادعا می شود رفتار آن با آن تابع موجی توصیف می شود. هر تابع موجی یک اوربیتال نامیده می شود. به عبارتی اوربیتال توصیف کننده رفتار موجی الکترون است و متناظر با یك نحوه ی خاص اشغال اطراف هسته توسط الكترون و یك سطح انرژی خاص برای الكترونی ست كه ادعا می شود در آن اوربیتال قرار دارد. کمیت های فیزیکی مورد علاقه از قبیل احتمال حضور الكترون در هر نقطه، مختصات نقاط با احتمال حضور الكترون بالاتر، فاصله میانگین الکترون از هسته، سطح انرژی الکترون و … برای هر الکترون با در دست داشتن تابع موجی الکترون مربوطه بدست می آیند. برای هر تابع موجی چنین کمیت هایی مقادیر بخصوص خودشان را خواهند داشت.
با وجود داشتن خصلت موجی در این مدل، برخی خصوصیات ذره مانند نیز همچنان پا بر جا هستند. مثلا مجموع ابرهای الکترونی معادل تعداد صحیحی از الکترون ها هستند. یا در واقع هر ابر الکترونی می تواند فقط معادل یک الکترون و یا یک و نیم الکترون باشد. بار منفی هر ابر الکترونی نیز همان بار منفی یک الکترون و نه کمتر و نه بیشتر خواهد بود. الکترون می تواند از حالت مربوط به یک ابر الکترونی یا اوربیتال به حالت یک ابر الکترونی یا اوربیتال دیگر تغییر حالت دهد. این انتقالات الکترونی ذره مانند خواهند بود، مثلا با جذب یا نشر یک فوتون انتقال یک الکترون را خواهیم داشت.
قابل توجه عزیزان، مطالب فوق کمک آموزشی می باشد. همچنین جهت کمک به شما برای درک بهتر مفهوم این مطلب ذکر شده است. برای دریافت اطلاعات کافی از مفهوم کلی درس به تماشای فیلم زیر بنشینید.
پس از تماشای ویدئو هرگونه سوال و مطلبی برای بیان دارید، بیان کنید در اسرع وقت به سوالات شما پاسخ داده خواهد شد.




