تیتراسیون (Titration) یکی از فرآیند های بسیار مهم در علم شیمی به ویژه در شیمی تجزیه و علوم آزمایشگاهی می باشد. این فرآیند یک روش ساده و کاربردی برای تعیین غلظت محلول مجهول می باشد. در واقع به افزودن آرام و آهسته یک محلول با غلظت معلوم (محلول استاندارد) به حجم مشخصی از یک محلول با غلظت نا مشخص و نا معلوم گفته می شود.
تیتراسیون اسید-باز در یک محلول چگونه است؟
تیتراسیون یا تیتر کردن و یا تیترامتری نیز نامیده میشود. در علم شیمی عبارت است از تعیین غلظت یک محلول مجهول با روشهای مختلف. یک روش آزمایشگاهی معمول کمی در شیمی تجزیه است. این روش برای اندازهگیری غلظت نامعلوم یک آنالیت استفاده میشود. از شناخته شدهترین تیتراسیونها، تیتراسیون اسید-باز است. چون اندازهگیری حجم در تیتراسیون را آنالیز حجمی می نامند که موضوع خیلی مهمی نیز هست. یک واکنشگر ناب که تیترانت یا تیتراتور نامیده میشود. به عنوان یک محلول مناسب استفاده میگردد. یک حجم از تیترانت با غلظت مشخص با یک محلول یا آنالیت واکنش میدهد تا غلظتش مشخص شود. حجم تیترانت واکنش داده را تیتر مینامند.
در این ویدئو آموزش می بینید که با استفاده از تیتراسیون اسید-باز چگونه می توان pH یک محلول شیمیایی را بر حسب حجم و غلظت یک ماده را تعیین کرد. همچنین اختلاف pH در نقاط قبل و ختم عمل و بعد از آن چگونه است؟
اصطلاحات تیتراسیون
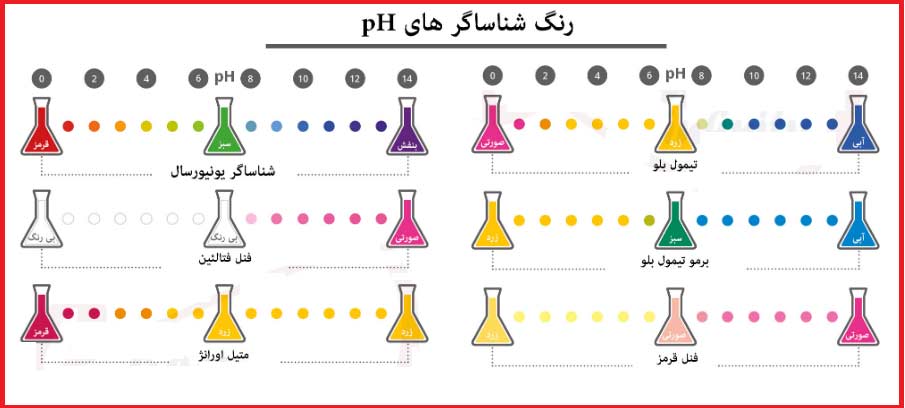
- آنالیت یا نمونه : به محلولی گفته می شود که غلظت و یا درصد خلوص آن نا معلوم است و باید مشخص گردد.
- تیترانت : به محلولی گفته می شود که دارای غلظت و فرمول شیمیایی مشخص و معین می باشد و جهت تعیین غلظت و یا درصد خلوص آنالیت استفاده می شود. به تیترانت، محلول استاندارد، تیتراتور و یا معرف نیز گفته می شود.
- شناساگر : به ماده رنگی گفته می شود که با تغییر رنگ آن، می توان متوجه پایان یافتن واکنش بین تیترانت و نمونه شد. شناساگر معمولا یک اسید و یا باز ضعیف است.
منحنی تیتراسیون
منحنی معمول تیتراسیون اسید-باز که با پایه قوی تیتر میشود. که تیتر شدن اکسالیک اسید نشان داده شدهاست. هر دو نقطه همارزی قابل مشاهده هستند. منحنی تیتراسیون منحنی است که محور x آن حجم تیترانتی را نشان میدهد که از اول واکنش اضافه شدهاست. محور y هم غلطت آنالیت در آن حجم میباشد. در موارد اسیدی محور y با pH حلال را نشان میدهد.
در تیتراسیون اسیدی، منحنی تیتراسیون قدرت اسید و پایه را نشان میدهد. برای یک اسید و باز قوی، منحنی ملایم و با شیب زیاد در نقطه همارزی خواهد بود. به همین دلیل، یک تغییر کوچک در حجم تیترانت در نزدیک نقطه همارزی، پیاچ را به شدت تغییر میدهد و شاخصهای زیادی را برای آن میتوان اختصاص داد (برای مثال کاغذ تورنسل، فنول فتالئین یا برموتیمول آبی).
اگر در شرایطی یکی از دو عامل اسید و باز قوی و دیگری ضعیف باشد، منحنی نامنظم خواهد بود و با تغییر کم حجم در نزدیکی نقطه همارزی، پیاچ کمتر تغییر میکند. برای مثال، منحنی تیتراسیون، اسید اگزالیک (اسید ضعیف) با سدیم هیدروکسید (باز قوی) نشان داده شدهاست. نقطه همارزی بین پیاچ ۸-۱۰ اتفاق میافتد، این موضوع نشان میدهد که حلال در نقطه همارزی خاصیت باز را دارد و نشانگر مورد نظر فنول فتالئین است. منحنی تیتراسیون برای یک اسد قوی و باز ضعیف نیز این چنین است و حلال خاصیت اسیدی گرفته و باید از شاخصهای متیل اورانژ و برموتیمول آبی استفاده شود.
نکته:
تیتراسیون بین اسید ضعیف و باز ضعیف دارای نامنظمی شدید است، به همین دلیل، یک شناساگر قطعی برای این حالت وجود ندارد و از یک pHسنج برای نشان دادن واکنش استفاده میشود.
در پایان این ویدئو هر کدام از دانشجویان عزیز اگر در مورد این بحث سوال و موردی برای بیان دارند می توانند در پایین پیج بصورت مکتوب سوالات و پیشنهادات خود را بنویسند در اسرع وقت به سوالات شما پاسخ داده خواهد شد.




