جداسازی در صنعت برای موارد بسیاری کاربرد دارد . مواد اولیه برای استفاده معمولا نیاز به جداسازی دارند. محصولات نیز به دو دسته جانبی و اصلی تقسیم می شوند که نیاز به جداسازی دارند. برای برگرداندن آب و هوای استفاده شده در صنایع به طبیعت و تصفیه پسماندهای صنعتی نیز به فرآیند جداسازی نیاز می باشد. بيشتر تجزيه هاي شيميايي، فقط برای يك تركيب بخصوص نمي باشند. بلکه در واقع به بسياري از تداخل كننده ها پاسخ مي دهند.
جداسازی یون ها
در شیمی میتوان به کمک روشهای جداسازی یون ها ، یک آنالیت یا دیگر ترکیبات شیمیایی را از یکدیگر جدا کرد. البته این کار زمانی انجام میشود که مواد، حداقل در یکی از خواص فیزیکی یا شیمیایی، اختلاف زیادی داشته باشند. در حقیقت، یکی از مهمترین فعالیتهای شیمیدانها، شامل جداسازی مواد و خالصسازی ترکیبات شیمیایی است. انواع روش های جداسازی یون ها بصورت زیر می باشد:
- استخراج
- تقطير
- رسوب گیری
- كروماتوگرافي
- روش هاي ديگر (سانتريفيوژ، فيلتراسيون و …)
تعیین غلظت محلولها
در ادامه مبحث جداسازی یونها به میزان غلظت، معیاری برای سنجش میزان اختلاط یک ماده، در مادهای دیگر است. محلولها میتوانند رقیق یا غلیظ باشند. به طور مثال وقتی میگوییم سرکه، محلول ۵ درصد استیک اسید در آب است، در حقیقت غلظت آن را ذکر کردهایم. اگر این میزان به ۱۰ درصد افزایش پیدا کند، محلول مورد نظر غلیظتر از سرکه است.
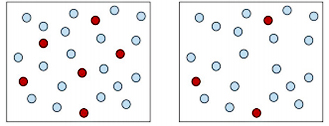
غلظت محلول سمت چپ بیشتر از سمت راست است
یک محلول غلیظ، محلولی است که مقادیر زیادی از حل شونده در مقدار مشخصی از حلال در آن حضور دارند. در مقابل، محلول رقیق، محلولی است که مقادیر حلشونده در آن برای مقدار مشخصی از حلال، کم باشد.
همانطور که اشاره شد، عبارات غلیظ و رقیق برای توصیف کیفی محلولها مورد استفاده قرار میگیرند اما نیاز داریم تا روشهایی برای توصیف کمی محلولها پیدا کنیم.
در این ویدئوی آموزشی روش محاسباتی جداسازی یون ها در یک محلول را با استفاده از روش رسوب گیری محلولها خواهید دید و با مفهوم جداسازی یون ها آشنا خواهید شد و همچنین روش تعیین میزان غلظت یک ماده در تعادلات جداسازی یونی را درک خواهید کرد.




