سلول الکتروشیمیایی (Electrochemical cell) به دستگاهی میگویند که از طریق واکنشهای شیمیایی درون آن، انرژی الکتریکی تولید میکند. در هر فرآیند الکتروشیمیایی، الکترونها از یک ماده شیمیایی به دیگری از طریق واکنش اکسایش-کاهش، جریان پیدا میکنند. واکنش اکسایش کاهش زمانی بوجود میآید که الکترونها از مادهای اکسید شده به ماده در حال کاهش، منتقل شوند. در این نوع از فرآیندها، «کاهنده» به مادهای میگویند که الکترون از دست میدهد و اکسید میشود. «اکسنده» نیز به ذراتی گفته میشود که در طول فرآیند، با پذیرش الکترون، کاهش مییابند.
همانطور که گفته شد یک سلول الکتروشیمیایی دستگاهی است که قادر به تولید انرژی الکتریکی از واکنش های شیمیایی یا استفاده از انرژی الکتریکی برای ایجاد واکنش های شیمیایی است. سلولهای الکتروشیمیایی که جریان الکتریسیته تولید می کنند، سلول های ولتائیک یا سلول های گالوانیکی نامیده می شوند و آنانی که به طور مثال از طریق الکترولیز واکنش های شیمیایی را تولید می کنند، سلول های الکترولیتی نامیده می شوند.
کاربرد سلول الکتروشیمیایی
چنین سلولهایی که توانایی تولید جریان الکتریکی را به کمک واکنشهای شیمیایی دارند. موسوم به «سلول گالوانی» (Galvanic Cell) یا سلول ولتاییک هستند. به عکس، سلول الکتروشیمیایی که در آنها، انجام واکنشهای شیمیایی به کمک اعمال یک جریان الکتریکی انجام میشود. در دسته سلولهای الکترولیتی جای میگیرند. در تصویر زیر، شکل کلی اجزای یک سلول الکتروشیمیایی نشان داده شده است.
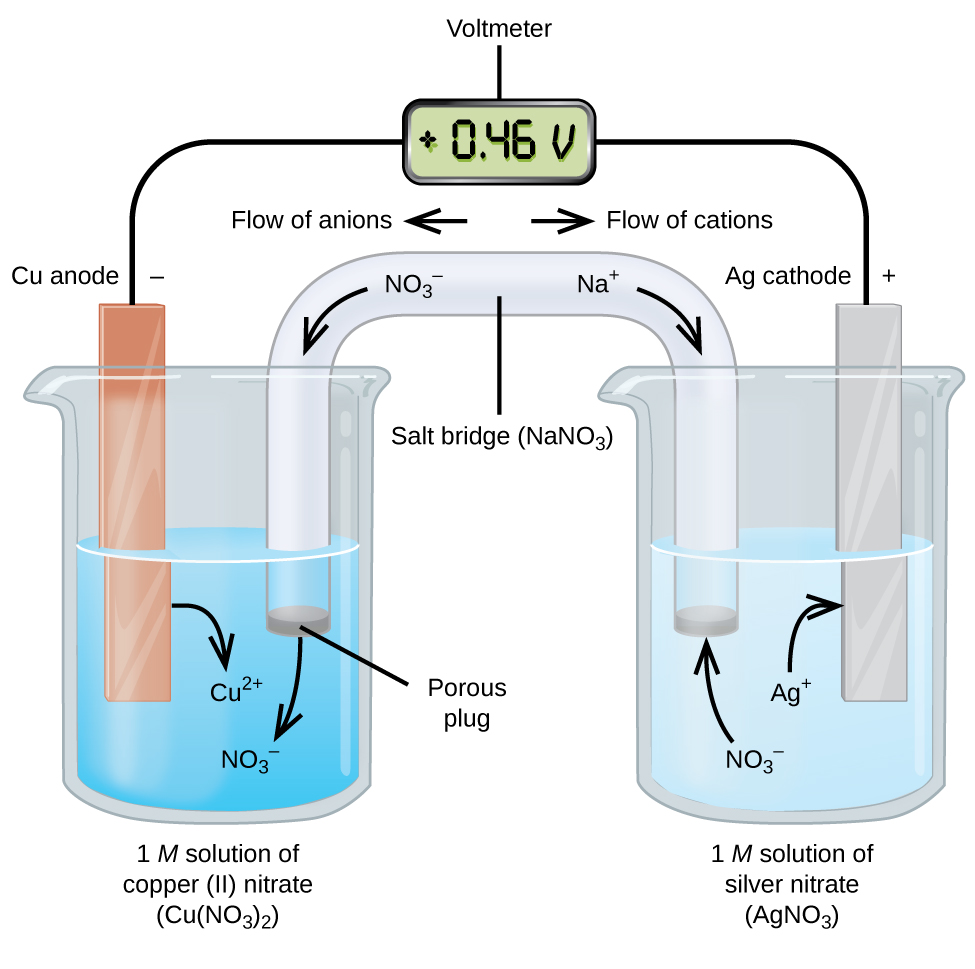
توجه داشته باشید که به هنگام نمایش یک سلول الکتروشیمیایی، کاتد در سمت راست و آند در سمت چپ نمایش داده میشود.
جهت تکمیل مدار و اتصال دو نیمواکنش، از یک سیم خارجی کمک میگیریم. با پیشرفت واکنش، الکترونها از کاهنده به اکسنده و به کمک سیم الکتریکی، جریان پیدا میکنند. در اثر این فرآیند، انرژی الکتریکی ایجاد میشود که میتوان به کمک آن، کار انجام داد. به دستگاهی که به منظور تولید انرژی الکتریکی از یک واکنش خودبهخودی اکسایش کاهش استفاده میشود، سلول الکتروشیمیایی میگویند.
سلول گالوانی
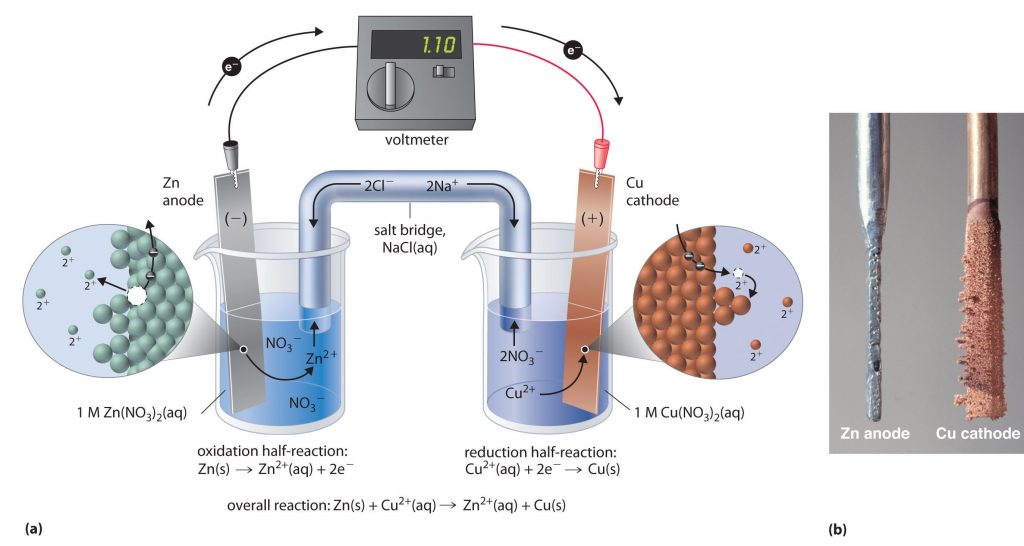
یک سلول گالوانی (Galvanic cell)، با استفاده از انرژی آزاد شده به هنگام انجام واکنش خودبهخودی اکسایش کاهش، انرژی الکتریکی تولید می کند. این نوع از سلول الکتروشیمیایی را همچنین با نام سلولهای ولتاییک میشناسند. سلول الکتروشیمیایی گالوانی یا ولتایی دستگاهی است که انرژی شیمیایی را به انرژی الکتریکی تبدیل می کند. در واقع به کمک واکنش های شیمیایی، جریان برق تولید می کند. از اتصال دو نیم سلول، یک سلول الکتروشیمیایی گالوانی ساخته می شود. برای مثال سلول الکتروشیمیایی (Zn-Cu) از دو نیم سلول روی و مس تشکیل شده است.
طریقه ساخت سلول الکتروشیمیایی
در سلول الکتروشیمیایی (Zn-Cu) ، از آنجایی که نیم سلول روی E° کوچکتری دارد تمایل بیشتری برای دادن الکترون داشته و الکترون ها از آن خارج شده و به سمت الکترود مس حرکت می کنند. خروج الکترون ها از نیم سلول روی باعث می شود تا تعادلی که قبلا در این نیم سلول برقرار بود، یعنی تعادل Zn2+(aq) + 2e– <—> Zn(s) به هم بخورد. بنابراین در جهت برگشت یعنی در جهت اکسایش پیش برود تا کمبود الکترون های خارج شده در آن جبران شود. در اثر این جابه جایی اتم های روی به یون هایZn2+(aq) تبدیل می شوند و به مرور جرم تیغه ی روی کاهش می یابد.
با ورود الکترون ها به الکترود مس تعادلی که قبلا در این الکترود برقرار بود یعنی تعادل Cu2+(aq)+ 2e– <—> Cu(s) بر هم می خورد. برای همین مصرف الکترون های وارد شده در جهت رفت یعنی در جهت کاهش پیش می رود. در اثر این جابه جایی کاتیون های Cu2+(aq) با جذب الکترون ها از سطح تیغه تبدیل به اتم های Cu می شوند و جرم تیغه ی مس افزایش می یابد. حال با توجه به این توضیحات باید بدانید که الکترودی که E° منفی تری دارد اکسایش می یابد و الکترودی که E° مثبت تری دارد کاهش می یابد.
معرفی اجزای سلول الکتروشیمیایی
- آند الکترودی است که در آن عمل اکسایش انجام می شود و در آن از رسانای یونی به رسانای الکترونی، الکترون داده می شود.
- کاتد الکترودی است که در آن عمل کاهش صورت می گیرد و در آن از رسانای الکترونی به رسانای یونی، الکترون داده می شود.
- قطب منفی الکترودی است که تراکم نسبی الکترون در سطح آن بیش تر بوده و E° منفی تری دارد.
- قطب مثبت الکترودی است که تراکم نسبی الکترون در سطح آن کمتر بوده و E° مثبت تری دارد.
- با توجه به تعاریف بالا در سلول شیمیایی (Zn-Cu) ، نیم سلول روی نقش آند را داشته و قطب منفی است. هم چنین نیم سلول مس نقش کاتد را داشته و قطب مثبت است .
- علامت های + و – ربطی به نامگذاری الکترودها به صورت آند و کاتد ندارند.
- در سلول الکتروشیمیایی گالوانی جهت حرکت الکترون ها از آند به طرف کاتد است.
در پایان این مبحث اگر سوال و مطلبی در مورد سلول الکتروشیمیایی بوجود آمد. می توانید در پایین صفحه آن را بیان کنید. در اسرع وقت به آنها پاسخ داده خواهد شد.




